細胞機能イメージングのための多機能走査型バイオプローブ顕微鏡
- ホーム
- 研究紹介
- オンチップ細胞機能解析システム(Cellular MEMS)
- 細胞機能イメージングのための多機能走査型バイオプローブ顕微鏡
- オンチップ細胞サージェリーシステムのための
細胞穿刺用マイクロニードルアレイ - セルパターニングのための
細胞操作用マイクロマニピュレータアレイ - 細胞機能制御のための
圧電駆動型マイクロ細胞培養デバイス - 細胞形態イメージングのための
多点同時計測イオンコンダクタンス顕微鏡 - 細胞機能イメージングのための
多機能走査型バイオプローブ顕微鏡
細胞機能イメージングのための多機能走査型バイオプローブ顕微鏡
生命機能機序の新たな知の創出を支援するキーテクノロジーとして,細胞の機能発現過程における 様々な生体機能情報(物理量・化学量)を空間的・時間的に可視化(細胞機能イメージング)する新規な “多機能走査型バイオプローブ顕微鏡”の開発を行っています.図1に本提案技術のキーデバイスとなる “ナノニードル搭載型バイオプローブ”の概略図を示します.本プローブの最大の特徴は,原子間力顕微鏡(AFM)で 使用される通常の探針(中実の針状構造体)のかわりに,中空構造を有するSiO2製の 先鋭化ナノニードル(先端径<50nm)がSi製カンチレバー先端に一体形成されていることにあります.さらに, カンチレバー内部に形成したマイクロ流路と連通させることで,微小流体のハンドリングが可能な構造となっています. このため, ①AFM形状観察・物性評価機能に加えて,生細胞に穿刺したナノニードルを介して, ②生体分子(DNA,mRNA,タンパク質など)の高精度な注入(生化学的刺激付与)や ③細胞内で発現した極微量の物質(tRNA,タンパク質など)の採取(生化学的応答計測)が可能となり, 他に類を見ない革新的な新機能を実現することができます.図2にMEMS技術によって試作した ナノニードル搭載型バイオプローブの一例を示します.Siカンチレバー(長さ680μm,幅40μm,厚さ20μm)の先端部に, 探針となる中空構造を有するSiO2製の先鋭化ナノニードル(根本の外径4.5μm,全長65μm,突出部長さ35μm)が 形成されています.さらに,ニードルに十分な機械的強度をもたせるために開発した独自技術によって,根本部分に Si構造体(幅78μm,高さ30μm)を位置選択的に形成しています.また,集束イオンビーム(FIB)加工を用いて, ニードル先端部を斜めにカットすることで,曲率半径を50nm以下に保ちつつ,1.0μm×1.5μmの開口部を形成しています. 図3(左図)に培養液中での生細胞(HeLa細胞:ヒト子宮頸癌由来細胞株)のAFM観察結果(50×50μm2画像)を 示します.図のように,細胞表面の微細構造も明瞭に観察することができました.また,生細胞への穿刺実験の結果(右図) から,培養液中に添加した染色用色素が細胞内へ導入されており,細胞膜を穿孔したことがわかります.ここで,蛍光色素の 発色は穿刺後も細胞が生きた状態を維持していることを意味しています.さらに, 探針部が絶縁体SiO2中空構造である利点を生かすことで, ④走査型イオンコンダクタンス顕微鏡(SICM), ⑤走査型近接場光学顕微鏡(SNOM), ⑥パッチクランプ(PC)法の既存技術の性能・機能をさらに高度化することができます. このため,現状の技術では個別の評価・分析手法によって取得していた生体機能情報を複数同時に取得できることになり, 情報の質(空間的・時間的相関計測を実現)を格段に向上させることができます.
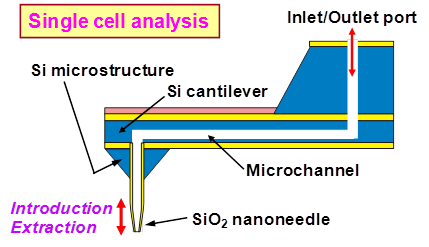
図1 ナノニードル搭載型バイオプローブ

図2 ナノニードル搭載型バイオプローブの作製例
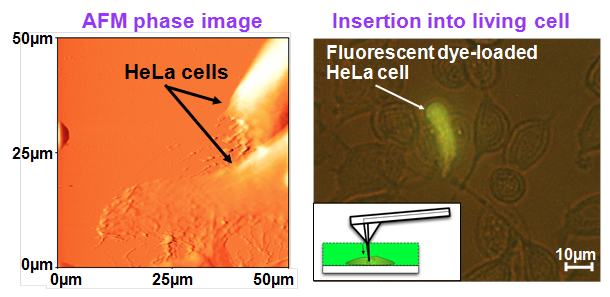
図3 培養液中でのHeLa細胞のAFM位相像(左)と穿刺実験の結果(右)
関連論文:
[1] T. Shibata et al., Proceedings of MEMS 2011 conference, Cancun, Mexico, pp.861-864, 2011.
[2] N. Kato et al., Microelectron. Eng., 87 (5-8), pp.1185-1189, 2010.
共同研究先:
大阪大学 林 照剛 准教授
東京医科歯科大学 木村 剛 助教
弘前大学 牧野英司 教授
形大学 峯田 貴 教授